化学/酸とアルカリ/酸の実体
ナビゲーションに移動
検索に移動
POINT!
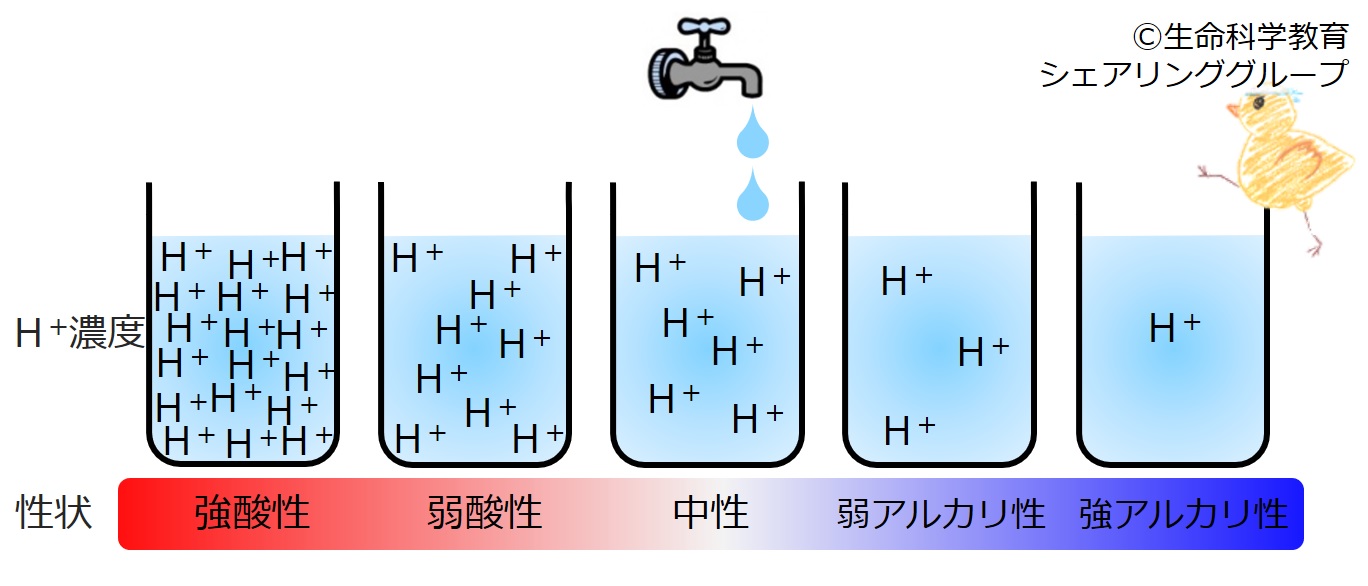
| 水溶液中の水素イオン(H+)が多いほど酸性が強い。逆に、水素イオン(H+)が少ないほどアルカリ性が強い。 |
酸の実体とは、水素イオン(H +)なのです。水溶液中の水素イオン濃度がその溶液の酸性、アルカリ性を決定します。
真水にはH2Oしかないわけではないのです。ある一定濃度の水素イオンH( +)があります。
水素イオン濃度が真水より 低い水溶液は アルカリ性であり、高い水溶液は酸性
です。また、
水素イオン濃度が 低いほどアルカリ性が強く、 高いほど 酸性が強い
のです。
Challenge Quiz
1.
ある水溶液中の水素イオン濃度が真水より高いとき、その溶液は、 酸性. アルカリ性 である。
ある水溶液中の水素イオン濃度が真水より低いとき、その溶液は、 酸性.アルカリ性 である。
酸の実体とは 酸素. 酸素イオン. 水素.水素イオン である。