「化学/酸とアルカリ/酸の実体」の版間の差分
ナビゲーションに移動
検索に移動
編集の要約なし |
編集の要約なし |
||
| 1行目: | 1行目: | ||
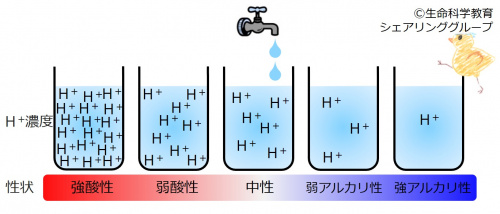
{{Point|水溶液中の水素イオン(H<sup>+</sup>)が多いほど酸性が強い。逆に、水素イオン(H<sup>+</sup>)が少ないほどアルカリ性が強い。}} | {{Point|水溶液中の水素イオン(H<sup>+</sup>)が多いほど酸性が強い。逆に、水素イオン(H<sup>+</sup>)が少ないほどアルカリ性が強い。}} | ||
[[ファイル:04390.jpg|none|500px]] | [[ファイル:04390.jpg|none|500px]] | ||
2015年7月17日 (金) 12:19時点における版
POINT!
| 水溶液中の水素イオン(H+)が多いほど酸性が強い。逆に、水素イオン(H+)が少ないほどアルカリ性が強い。 |
酸の実体とは、水素イオン(H +)なのです。水溶液中の水素イオン濃度がその溶液の酸性、アルカリ性を決定します。
真水にはH2Oしかないわけではないのです。ある一定濃度の水素イオン(H +)があります。
水素イオン濃度が真水より 低い水溶液は アルカリ性であり、高い水溶液は酸性
です。また、
水素イオン濃度が 低いほどアルカリ性が強く、 高いほど 酸性が強い
のです。
Challenge Quiz
1.
ある水溶液中の水素イオン濃度が真水より高いとき、その溶液は、 酸性 アルカリ性 である。
2.
ある水溶液中の水素イオン濃度が真水より低いとき、その溶液は、 酸性 アルカリ性 である。
3.
酸の実体とは 酸素 酸素イオン 水素 水素イオン である。