「化学/原子の電気/イオンの種類/カリウムイオン」の版間の差分
ナビゲーションに移動
検索に移動
編集の要約なし |
編集の要約なし |
||
| (同じ利用者による、間の4版が非表示) | |||
| 1行目: | 1行目: | ||
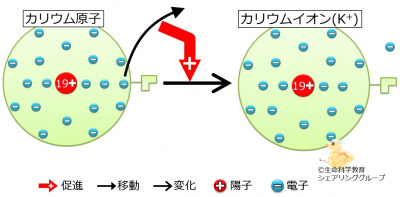
{{Point| | {{Point|カリウム原子は電子を1個失って1価の陽イオンとなる。}} | ||
[[メディア:カリウムイオン.mp4|動画と音声での説明 ]] | |||
[[ファイル: | [[ファイル:カリウムのイオン.jpg|alt=カリウムのイオン.jpg|left|400px]] | ||
カリウム原子の「連結器」の数は1個です。カリウム原子は電子を<strong><font color="#ff0000">1</font></strong>個失うために、「連結器」も<strong><font color="#ff0000">1</font></strong>個なのです。電気的に陰性である電子を<strong><font color="#ff0000">1</font></strong>個失うため、カリウムイオンは電気的に<strong><font color="#ff0000">1</font></strong>個(このことは1価と言います)陽性です。このため、カリウムイオンは<br> | カリウム原子の「連結器」の数は1個です。カリウム原子は電子を<strong><font color="#ff0000">1</font></strong>個失うために、「連結器」も<strong><font color="#ff0000">1</font></strong>個なのです。電気的に陰性である電子を<strong><font color="#ff0000">1</font></strong>個失うため、カリウムイオンは電気的に<strong><font color="#ff0000">1</font></strong>個(このことは1価と言います)陽性です。このため、カリウムイオンは<br> | ||
K<sup>+</sup><br> | K<sup>+</sup><br> | ||
と表記されます。K<sup>1+</sup>の方が正しいのですが、通常1は省略します。<br> | と表記されます。K<sup>1+</sup>の方が正しいのですが、通常1は省略します。 | ||
<br style="clear:both;" /> | |||
{{QuizTitle}} | {{QuizTitle}} | ||
<GIFT> | <GIFT> | ||
//LEVEL:2 | //LEVEL:2 | ||
カリウムイオンは電気的に {=陽性 | カリウムイオンは電気的に {=陽性~陰性}である。 | ||
//LEVEL:2 | //LEVEL:2 | ||
カリウムイオンは{=1 | カリウムイオンは{=1~2}価の {=陽~陰}イオンである。 | ||
//LEVEL:2 | //LEVEL:2 | ||
K<sup>+</sup>は{=1 | K<sup>+</sup>は{=1~2}価の {=陽~陰}イオンである。 | ||
</GIFT> | </GIFT> | ||
2018年4月2日 (月) 14:48時点における最新版
POINT!
| カリウム原子は電子を1個失って1価の陽イオンとなる。 |
カリウム原子の「連結器」の数は1個です。カリウム原子は電子を1個失うために、「連結器」も1個なのです。電気的に陰性である電子を1個失うため、カリウムイオンは電気的に1個(このことは1価と言います)陽性です。このため、カリウムイオンは
K+
と表記されます。K1+の方が正しいのですが、通常1は省略します。
Challenge Quiz
1.
カリウムイオンは電気的に 陽性 陰性 である。
2.
カリウムイオンは 1 2 価の 陽 陰 イオンである。
3.
K+は 1 2 価の 陽 陰 イオンである。