「化学/原子の電気/イオンの種類/水素イオン」の版間の差分
ナビゲーションに移動
検索に移動
編集の要約なし |
編集の要約なし |
||
| 1行目: | 1行目: | ||
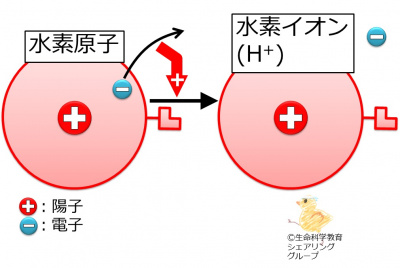
{{Point|水素原子は電子を1個失って1価の陽イオンとなる。}} | {{Point|水素原子は電子を1個失って1価の陽イオンとなる。}} | ||
[[メディア:水素イオン.mp4|動画と音声での説明 ]] | [[メディア:水素イオン.mp4|動画と音声での説明 ]] | ||
[[ファイル:水素イオン.jpg|alt= | [[ファイル:水素イオン.jpg|alt=水素のイオン.jpg|left|400px]] | ||
「[http://life-science-edu.net/wiki/%E5%8C%96%E5%AD%A6/%E5%8E%9F%E5%AD%90/%E7%B5%90%E5%90%88/%E3%80%8C%E9%80%A3%E7%B5%90%E5%99%A8%E3%80%8D%E3%81%AE%E6%95%B0/%E6%B0%B4%E7%B4%A0%E5%8E%9F%E5%AD%90 水素原子の「連結器」の数は1個です]」を思い出して下さい。水素原子は電子を<strong><font color="#ff0000">1</font></strong>個失うために、「連結器」も<strong><font color="#ff0000">1</font></strong>個なのです。電気的に陰性である電子を<strong><font color="#ff0000">1</font></strong>個失うため、水素イオンは電気的に<strong><font color="#ff0000">1</font></strong>個(このことは1価と言います)陽性です。このため、水素イオンは<br> | 「[http://life-science-edu.net/wiki/%E5%8C%96%E5%AD%A6/%E5%8E%9F%E5%AD%90/%E7%B5%90%E5%90%88/%E3%80%8C%E9%80%A3%E7%B5%90%E5%99%A8%E3%80%8D%E3%81%AE%E6%95%B0/%E6%B0%B4%E7%B4%A0%E5%8E%9F%E5%AD%90 水素原子の「連結器」の数は1個です]」を思い出して下さい。水素原子は電子を<strong><font color="#ff0000">1</font></strong>個失うために、「連結器」も<strong><font color="#ff0000">1</font></strong>個なのです。電気的に陰性である電子を<strong><font color="#ff0000">1</font></strong>個失うため、水素イオンは電気的に<strong><font color="#ff0000">1</font></strong>個(このことは1価と言います)陽性です。このため、水素イオンは<br> | ||
H<sup>+</sup><br> | H<sup>+</sup><br> | ||
2017年3月13日 (月) 13:13時点における版
POINT!
| 水素原子は電子を1個失って1価の陽イオンとなる。 |
「水素原子の「連結器」の数は1個です」を思い出して下さい。水素原子は電子を1個失うために、「連結器」も1個なのです。電気的に陰性である電子を1個失うため、水素イオンは電気的に1個(このことは1価と言います)陽性です。このため、水素イオンは
H+
と表記されます。H1+の方が正しいのですが、通常1は省略します。
Challenge Quiz
1.
水素イオンは電気的に 陽性 陰性 である。
2.
水素イオンは 1 2 価の 陽 陰 イオンである。
3.
H+は 1 2 価の 陽 陰 イオンである。