「電解質と体液/pH調節関連の用語定義/酸性物質の分類-2-」の版間の差分
編集の要約なし |
編集の要約なし |
||
| 1行目: | 1行目: | ||
1.尿中の酸性物質がNaOHで中和されるかどうかの分類 | |||
<b>1-1滴定酸</b> | |||
=NaOH(強アルカリ)で中和される酸性物質。尿中の酸性物質を定量する際、多くの酸性物質を別々に定量することは困難かつ煩雑であるため、一定量の尿がどれだけのNaOHで中和されるか?で定量する。 | =NaOH(強アルカリ)で中和される酸性物質。尿中の酸性物質を定量する際、多くの酸性物質を別々に定量することは困難かつ煩雑であるため、一定量の尿がどれだけのNaOHで中和されるか?で定量する。 | ||
| 15行目: | 13行目: | ||
[[ファイル: | [[ファイル:00637.jpg|none|500px]] | ||
左上:乳酸、ケトン体、リン酸、硫酸などの「糸球体からろ過される不揮発性酸」が生体と同じ濃度で水溶液中にあると、多くの水素原子(H)を結合しており、同時に多くの水素イオン(H<sup>+</sup>)を解離してpHは約3となる。 | 左上:乳酸、ケトン体、リン酸、硫酸などの「糸球体からろ過される不揮発性酸」が生体と同じ濃度で水溶液中にあると、多くの水素原子(H)を結合しており、同時に多くの水素イオン(H<sup>+</sup>)を解離してpHは約3となる。 | ||
| 49行目: | 47行目: | ||
<b>1-2.滴定酸ではない酸性物質</b> | |||
| 57行目: | 55行目: | ||
<b>2.炭素を含むかどうかの分類</b> | |||
| 66行目: | 64行目: | ||
{{QuizTitle}} | {{QuizTitle}} | ||
<GIFT> | <GIFT> | ||
//LEVEL:3 | //LEVEL:3 | ||
2015年7月6日 (月) 16:53時点における版
1.尿中の酸性物質がNaOHで中和されるかどうかの分類
1-1滴定酸
=NaOH(強アルカリ)で中和される酸性物質。尿中の酸性物質を定量する際、多くの酸性物質を別々に定量することは困難かつ煩雑であるため、一定量の尿がどれだけのNaOHで中和されるか?で定量する。
- 尿において滴定酸を定量するときは、「尿のpHを(7.0ではなく)7.4にするのに必要なNaOHの量」が滴定酸の量である。
- 滴定酸にアンモニウムイオンは含まれない。
- 結局、滴定酸とは、正常人では、尿細管から分泌されたH+の量+HCO3-が再吸収されて排出したH+の量の総和のうち、「糸球体からろ過された不揮発性酸」に緩衝された量である。
- 酸血症、アルカリ血症のある患者では、滴定酸とは、尿細管から分泌されたH+の量+HCO3-が再吸収されて排出したH+の量+「糸球体からろ過される不揮発性酸」の増減分に結合しているHの量の総和である。
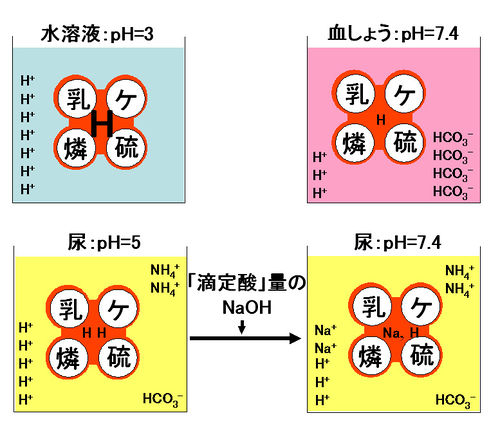
左上:乳酸、ケトン体、リン酸、硫酸などの「糸球体からろ過される不揮発性酸」が生体と同じ濃度で水溶液中にあると、多くの水素原子(H)を結合しており、同時に多くの水素イオン(H+)を解離してpHは約3となる。
右上:血漿では、同じ濃度の「糸球体からろ過される不揮発性酸」があっても重炭酸緩衝系(図中のHCO3-)に代表される血漿緩衝系がH+を中和して減少させ(H+の数は7→3に減少)、「糸球体からろ過される不揮発性酸」に結合しているHも減少させている。pHは7.4まで増大している。
左下:腎臓は、
*1.「糸球体からろ過される不揮発性酸」
*2.「尿細管から分泌される不揮発性酸」その1:HCO3-の再吸収による水素イオン(H+)の排出
*3.「尿細管から分泌される不揮発性酸」その2:水素イオン(H+)の分泌
により、酸性物質を排泄している(前述)。そのため、HCO3-は血漿よりも減少している(血漿では4コ、尿では1コ)。また、分泌、生成したH+は、
*1.「糸球体からろ過される不揮発性酸」による緩衝
*2.アンモニア(NH3)による緩衝を受ける(前述)。そのため、
*尿中には「糸球体からろ過される不揮発性酸」があり、血漿中でも結合していたH(赤い四葉のクローバの中心にある右側のH)ならびに、緩衝作用によって増えたH(左側のH)が結合している。
*尿中にはアンモニウムイオン(NH4+)がある。
*尿中のH+(5コ)は血漿中のH+(3コ)より多い。すなわち、尿のpHは血漿よりも低い。
右下:左下の尿にある一定量のNaOHを混入すると、pHは7.4にもどる。この際、尿中で血漿よりも増大した H+(2つ)も、「糸球体からろ過される酸性物質」に緩衝され結合したHも、ナトリウムイオン(Na+)ないし、ナトリウム(Na)に置換される。結局、解離しているH+の量も「糸球体からろ過される酸性物質」に結合しているHの量も血漿と同等となる。
1-2.滴定酸ではない酸性物質
=アンモニウムイオン
アンモニウムイオンはpH7附近ではH+を解離させないため、NaOHに中和されない=滴定酸ではない。
2.炭素を含むかどうかの分類
炭素(C)を含む酸性物質が「有機酸」であり、含まない酸性物質が「無機酸」である。乳酸、ケトン体などが有機酸であり、リン酸、硫酸、アンモニウムイオン(NH4+)などが無機酸である。
Challenge Quiz
アンモニウムイオンは滴定酸で ある はない 。
尿中の滴定酸の量は尿のpHを 7.0 7.4 にするのに必要な NaOH H3PO4 H2SO4 HCO3- の量である。
滴定酸に含まれるモノは、選択肢のうち、 正常人の血中にもある「糸球体からろ過される不揮発性酸」に結合しているHの量 腎不全患者などにおいて、「糸球体からろ過される不揮発性酸」の増量分に結合しているHの量 HCO3-が再吸収されて生成し、「糸球体からろ過された不揮発性酸」に緩衝されたH+の量 HCO3-が再吸収されて生成し、アンモニア(NH3)に緩衝されたH+の量 尿細管から分泌されて「糸球体からろ過された不揮発性酸」に緩衝されたH+の量 尿細管から分泌されてアンモニア(NH3)に緩衝されたH+の量 である。
乳酸は、 有機酸 無機酸 である。
ケトン体は、 有機酸 無機酸 である。
リン酸は、 有機酸 無機酸 である。
硫酸は、 有機酸 無機酸 である。