| H+の増大とHCO3-の減少とは代謝性アシドーシスを示唆する。 |
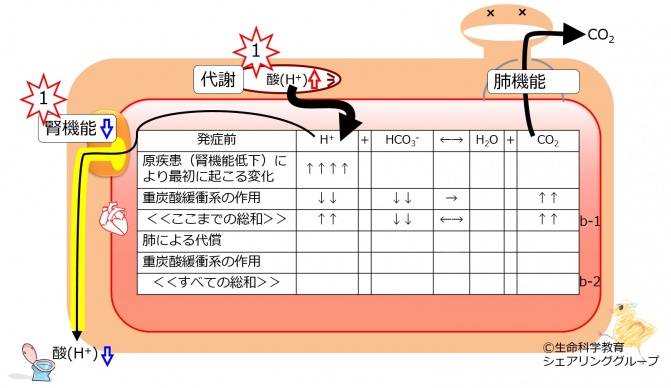
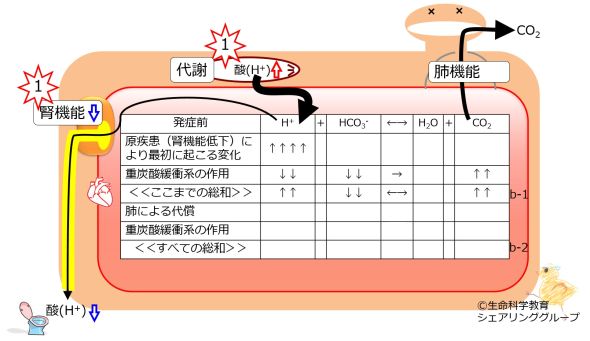
最初の病態として、酸が多く生成し、血中に放出れた場合を考えて見ましょう。あるいは、腎機能が低下した場合を考えてみましょう。
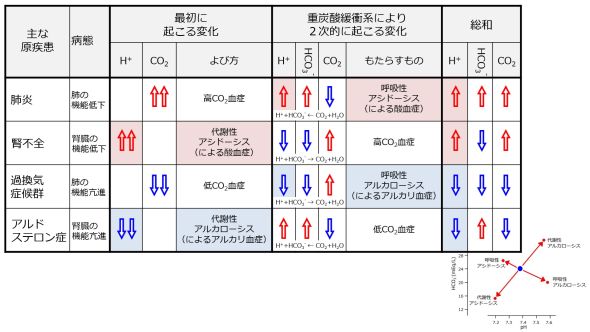
酸の排出が低下します。これらにより、血中の水素イオン(H+)が増大します。 重炭酸緩衝系のバランスが乱されたので、「最初に起こったことを打ち消す方向」、つまりこの場合は右方向に反応が進みます。これにより水素イオン(H+)が消費されるからです。右向き反応で消費されるため重炭酸イオン(HCO3-)は減少し、右向き反応で生成されるため二酸化炭素(CO2)が増大します。
「最初に起こったことが完全に打ち消されるわけではない」のですから、水素イオン (H+)が4増大すると、重炭酸緩衝系の作用により消費される水素イオン (H+)は、それよりも少ないので、2としましょう。重炭酸イオン(HCO3-)も2消費され減少し、二酸化炭素(CO2)は2生成され増加します。
最初の変化と重炭酸緩衝系の作用までをまとめると、このような新たな平衡が成り立ちます。
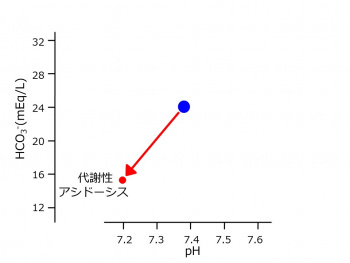
pHを横軸、重炭酸イオン(HCO3-)を縦軸とするグラフにおいて、水素イオン(H+)が増大することはpHが低下するので左方移動となります。重炭酸イオン(HCO3-)が減少することは下方移動となり、この状態はこのようにプロットされます。
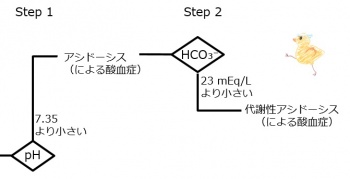
たとえば、pH, 7.08 ; HCO3-, 3 mEq/L ; CO2, 15 mm Hgの血液検査データでは、正常値よりも水素イオン濃度が増大し、重炭酸イオンは減少しています。これは、血漿における重炭酸緩衝系の化学平衡式H+ + HCO3- ←→ H2O + CO2において、左端にあるH+とHCO3-とが逆の方向に変動しており、血漿に最初に起こった変化はH+の増大と考えると説明がつきます。(HCO3-の減少も考えられますが、「上級編」に後述。)腎臓の糸球体が破壊される腎不全によってもたらされます。さらに、重炭酸緩衝系はH+ + HCO3- → H2O + CO2の方向に化学変化が生じたと考えられます。pHの変動は代謝性アシドーシス(による酸血症)とよばれます。
| pHの変動 | H+の変動 | HCO3-の変動 | 最初に起った変化 | 重炭酸緩衝系の動き | 診断される病態 |
|---|---|---|---|---|---|
| 低下 | 増大 | 減少 | H+の増大 | H+ + HCO3- → H2O + CO2 | 代謝性アシドーシス |
Challenge Quiz
H+ + HCO3- ←→ H2O + CO2 において、腎不全(腎臓の機能低下)そのものにより(重炭酸緩衝系の作用なしに)最初に起こる変化は 呼吸性アシドーシス(による酸血症) 代謝性アシドーシス(による酸血症) 呼吸性アルカローシス(によるアルカリ血症) 代謝性アルカローシス(によるアルカリ血症) 高CO2血症 低CO2血症 である。重炭酸緩衝系はこの変化に対して、 H+ + HCO3- ← H2O + CO2 H+ + HCO3- → H2O + CO2 方向に反応が進行する。これにより、HCO3-は 増大 減少 する。
H+ + HCO3- ←→ H2O + CO2 において、腎不全(腎臓の機能低下)そのものにより(重炭酸緩衝系の作用なしに)最初に起こる変化は 呼吸性アシドーシス(による酸血症) 代謝性アシドーシス(による酸血症) 呼吸性アルカローシス(によるアルカリ血症) 代謝性アルカローシス(によるアルカリ血症) 高CO2血症 低CO2血症 である。重炭酸緩衝系はこの変化に対して、 H+ + HCO3- ← H2O + CO2 H+ + HCO3- → H2O + CO2 方向に反応が進行する。これにより、HCO3-は 増大 減少 する。
動脈血のpH,7.08 (正常値:7.4);HCO3-,3 (正常値:24) mEq/L;CO2,15 (正常値:40) mm Hgの血液検査データでは、正常値よりも水素イオン濃度が 増大 減少 し、重炭酸イオンは 増大 減少 している。これは、血漿における重炭酸緩衝系の化学平衡式H++HCO3-←→H2O+CO2において、左端にあるH+とHCO3-とが 同じ 異なる 方向に変動しており、血漿に最初に起こった変化はH+の変動であると 思われる 思われない 。血漿に最初に起こった変化は H+ CO2 の 増大 減少 と考えると説明がつく。
動脈血のpH,7.08 (正常値:7.4);HCO3-,3 (正常値:24) mEq/L;CO2,15 (正常値:40) mm Hgの血液検査データでは、正常値よりも水素イオン濃度が 増大 減少 し、重炭酸イオンは 増大 減少 している。これは、血漿における重炭酸緩衝系の化学平衡式H++HCO3-←→H2O+CO2において、左端にあるH+とHCO3-とが 同じ 異なる 方向に変動しており、血漿に最初に起こった変化はH+の変動であると 思われる 思われない 。血漿に最初に起こった変化は H+ CO2 の 増大 減少 と考えると説明がつく。

動脈血のpH,7.08 (正常値:7.4);HCO3-,3 (正常値:24) mEq/L;CO2,15 (正常値:40) mm Hgの血液検査データは、 肺 腎臓 の機能 亢進 不全 によってもたらされたと思われる。さらに、重炭酸緩衝系は H+ + HCO3- ← H2O + CO2 H+ + HCO3- → H2O + CO2 の方向に化学変化が生じたと考えられる。pHの変動は 代謝性 呼吸性 アシドーシス(による酸血症) アルカローシス(によるアルカリ血症) とよばれる。
動脈血のpH,7.08 (正常値:7.4);HCO3-,3 (正常値:24) mEq/L;CO2,15 (正常値:40) mm Hgの血液検査データは、 肺 腎臓 の機能 亢進 不全 によってもたらされたと思われる。さらに、重炭酸緩衝系は H+ + HCO3- ← H2O + CO2 H+ + HCO3- → H2O + CO2 の方向に化学変化が生じたと考えられる。pHの変動は 代謝性 呼吸性 アシドーシス(による酸血症) アルカローシス(によるアルカリ血症) とよばれる。