| 代謝性アルカローシスに対して肺が代償すると、HCO3-がさらに増大し、CO2も比例して増大する。 |
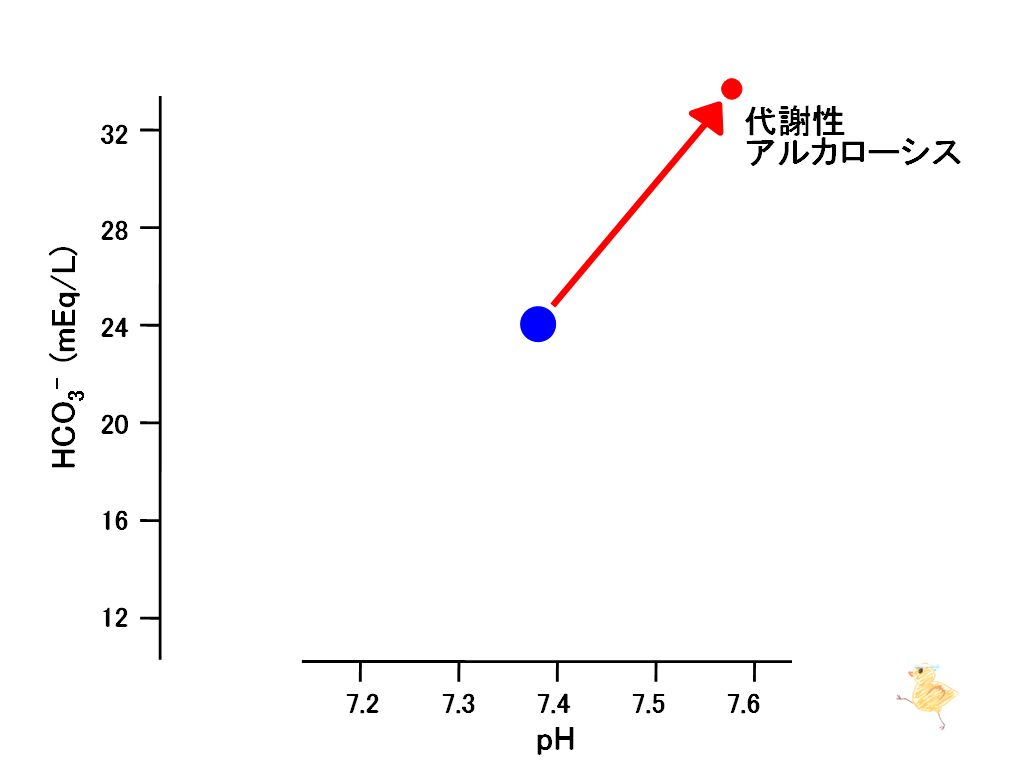
第6章では、腎臓の機能亢進によりアルカリ血症がもたらされ、重炭酸緩衝系がH+←CO2方向へ変換することでアルカリ血症が緩衝され、低CO2血症がもたらされることを学んだ。また、この際、重炭酸イオン(HCO3-)が増加することを学んだ。ここまでは下図のようにまとめられる。青丸は正常範囲であり、横軸はpH、縦軸はHCO3-濃度である。
重炭酸緩衝系により、アルカリ血症という負荷が肺と腎臓とで分担されたわけである。では、肺が分担すべき負荷をこなした、すなわち、不足するCO2の排泄を低下させた場合を検討してみよう。
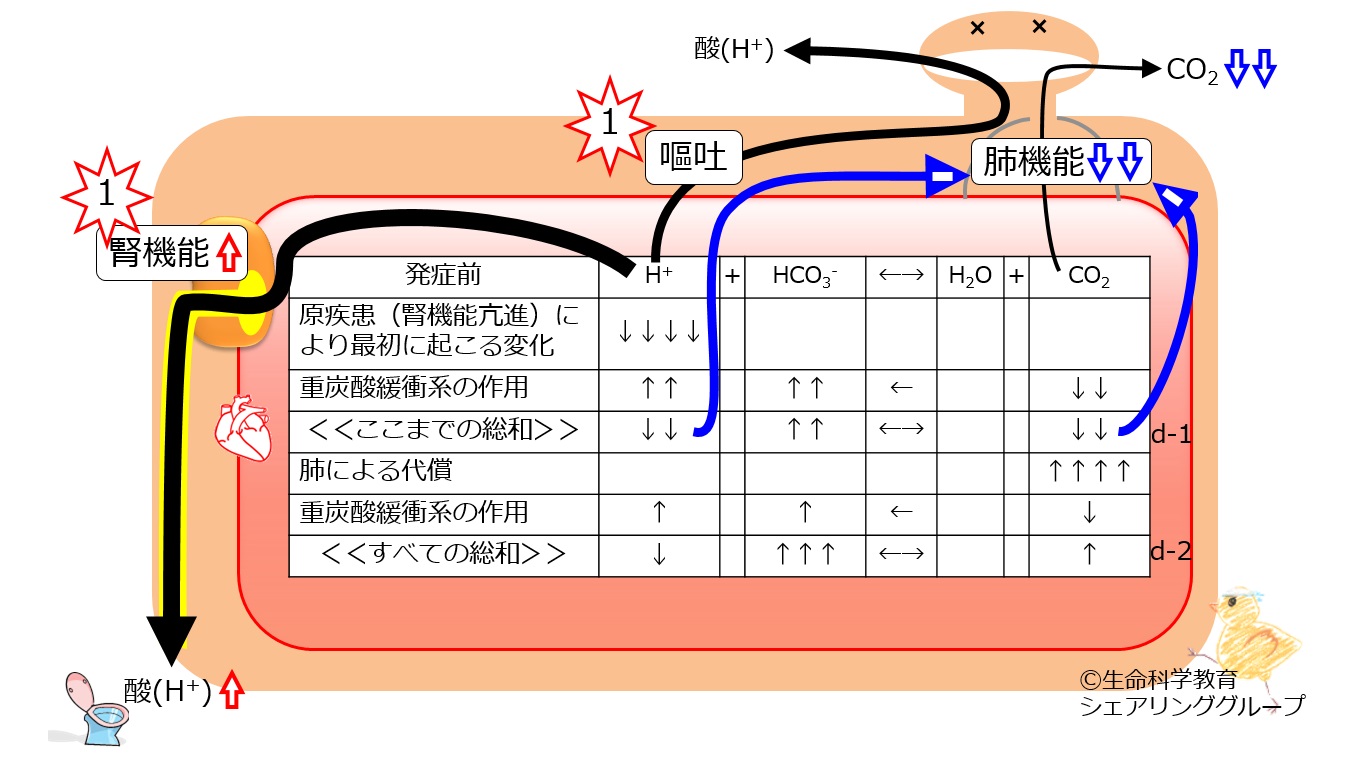
| 発症前 | H+ | + | HCO3- | ←→ | H2O | + | CO2 |
| 原疾患(腎臓の機能亢進)により最初に起こる変化 | ↓↓↓↓ | ||||||
| 重炭酸緩衝系の作用 | ↑↑ | ↑↑ | ← | ↓↓ | |||
| <<ここまでの総和>> | ↓↓ | ↑↑ | ←→ | ↓↓ | |||
| 肺による代償 | ↑↑↑↑ | ||||||
| 重炭酸緩衝系の作用 | ↑ | ↑ | ← | ↓ | |||
| <<すべての総和>> | ↓ | ↑↑↑ | ←→ | ↑ |
| 1段目(原疾患により最初に起こる変化)、2段目(重炭酸緩衝系の作用)、3段目(ここまでの総和) | 第6章で説明ずみである。ただし、矢印の数が2倍になっている。これは、単に説明の都合である。この状態で、重炭酸緩衝系は化学的平衡(←→)を保っている。 |
| 4段目(肺による代償) | 肺が分担すべき負荷をこなし、肺機能が代償的に低下する。理由はCO2量の低下だけではなく、代謝性アルカローシス(によるアルカリ血症)が直接的に呼吸を抑制するのである。両者とも呼吸を低下させるため、CO2は大きく増大(↑↑↑↑)する。 これは重炭酸緩衝系にとっては、新たな変化であり、3段目の平衡を崩す。 |
| 5段目 | 化学的平衡に外からの攪乱で変化が生じると、「変化を打ち消す方向」に化学反応が進むため、肺による代償(CO2↑↑↑↑)に対して
H+ + HCO3- ← H2O + CO2 方向に反応が進行する。また、「変化量より少ない量」化学反応が進むため、変化量は4段目より少なく、矢印は1本ずつである。 |
| 6段目(すべての総和) | 3段目から5段目までの(すなわち,1,2,4,5段目の)総和である。3段目、すなわち、肺の代償と重炭酸緩衝系の作用が加わる前の状態と比較してみよう。
*アルカリ血症(pH上昇)は緩衝(H+:↓↓→↓)されている |
なお、
HCO3-の(正常値=24 mEq/Lからの)増大量×(0.5〜1.0)
=CO2の(正常値=40 mmHgからの)増大量
と言われている。
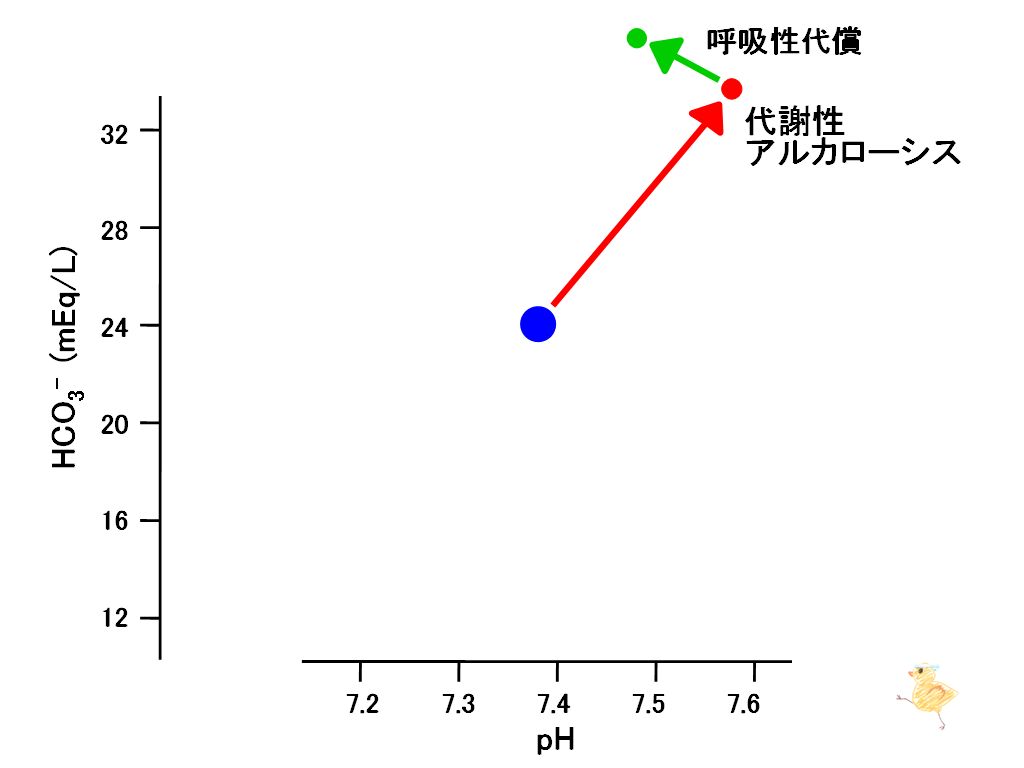
肺による代償と重炭酸緩衝系の作用が加わることにより、アルカリ血症(pH上昇)が緩衝され、HCO3-の上昇がさらに進行した様子を書き加えてみたのが左図である。
最初の病態として、嘔吐を発症し酸が排出され、体外に放出された場合を考えて見ましょう。 あるいは、腎機能が亢進した場合を考えてみましょう。酸の排出が増加します。これらにより、血中の水素イオン (H+)が減少します。
重炭酸緩衝系のバランスが乱されたので、「最初に起こったことを打ち消す方向」、つまりこの場合は左方向に反応が進みます。これにより水素イオン (H+)が生成されるからです。左向き反応で生成されるため重炭酸イオン(HCO3-)も増大し、左向き反応で消費されるため二酸化炭素(CO2) が減少します。
「最初に起こったことが完全に打ち消されるわけではない」のですから、水素イオン (H+)が4減少すると、重炭酸緩衝系の作用により生成される水素イオン (H+)は、それよりも少ないので、2としましょう。重炭酸イオン(HCO3-)は2生成され増加し、二酸化炭素(CO2)は2消費され減少します。
最初の変化と重炭酸緩衝系の作用までをまとめると、このような新たな平衡が成り立ちます。
pHを横軸、重炭酸イオン(HCO3-)を縦軸とするグラフにおいて、水素イオン(H+)が減少することはpHが上昇するので右方移動となります。重炭酸イオン(HCO3-)が増大することは上方移動となり、この状態はこのようにプロットされます。
二酸化炭素(CO2)が減少したことが、肺機能を抑制します。これだけではなく、水素イオン(H+)が減少したことも、肺機能を抑制(抑制の矢印ワイプ、肺機能低下の下向き矢印ワイプ)します。二酸化炭素(CO2)の排泄がとても少なくなります。これにより、血中の二酸化炭素(CO2)は大きく増加します。これは肺による代償とよばれています。
これは、新しい平衡状態にあった重炭酸緩衝系のバランスを乱すことになり、「最初に起こったことを打ち消す方向」、つまりこの場合も左方向に反応が進みます。これにより二酸化炭素(CO2)が消費されるからです。左向き反応で生成されるため水素イオン (H+)が増加し重炭酸イオン(HCO3-)も増加します。
ここまでの総和以降をまとめたこのような新たな平衡が成り立ちます。
pHを横軸、重炭酸イオン(HCO3-)を縦軸とするグラフにおいて、代謝性アシドーシスと比べ、水素イオン(H+)の減少は小さくなり、右方移動が小さくなります。また重炭酸イオン(HCO3-)の増加が大きくなり、上方移動は大きくなります。
この状態はこのようにプロットされます。
Challenge Quiz