電解質と体液/肺、腎による酸性物質の排出と血漿緩衝系のはたらき/重炭酸緩衝系の基本的作用/重炭酸緩衝系の原理
ナビゲーションに移動
検索に移動
POINT!
| 重炭酸緩衝系は化学平衡であり、H+とCO2の いずれかの物質が増減すると、その「最初の変化を打ち消す方向」に、「最初の変化より少ない量」化学反応が進む。 |
*ベースラインでは、H+もCO2も
H+ ←→ CO2 ( H+ + HCO3- ←→ H2O + CO2 )
の化学平衡にあり、濃度は正常範囲です。
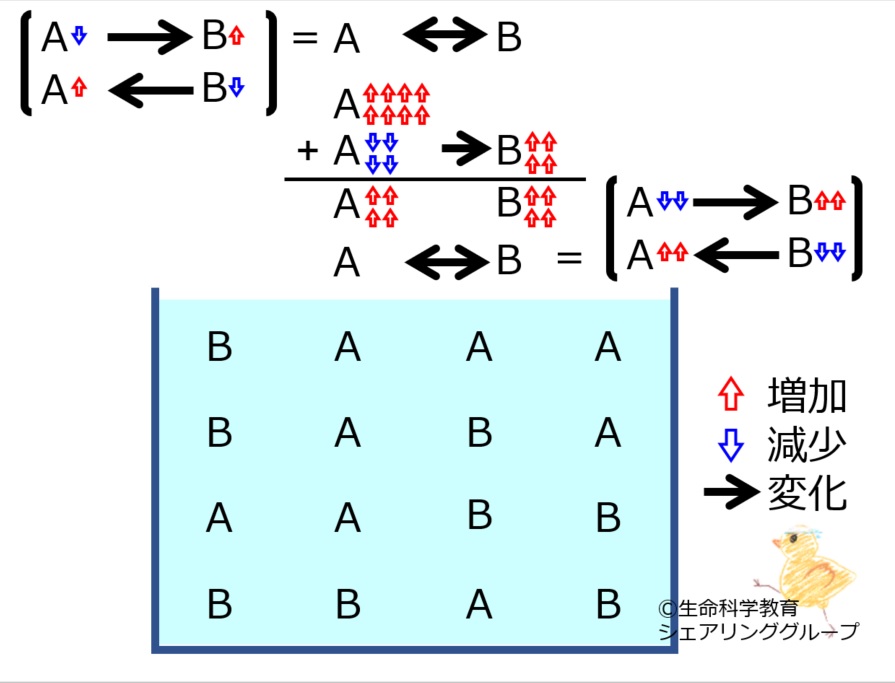
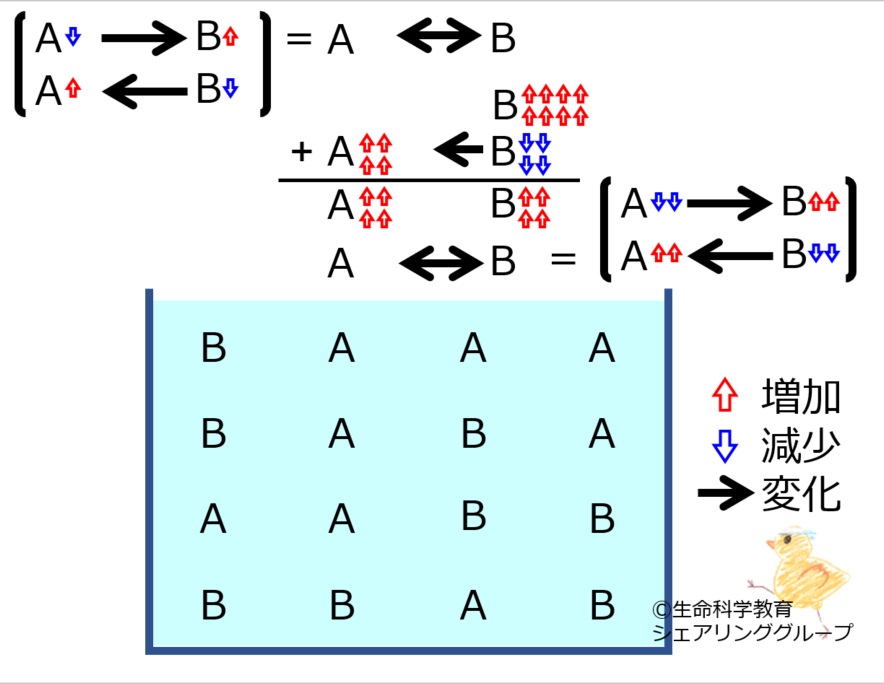
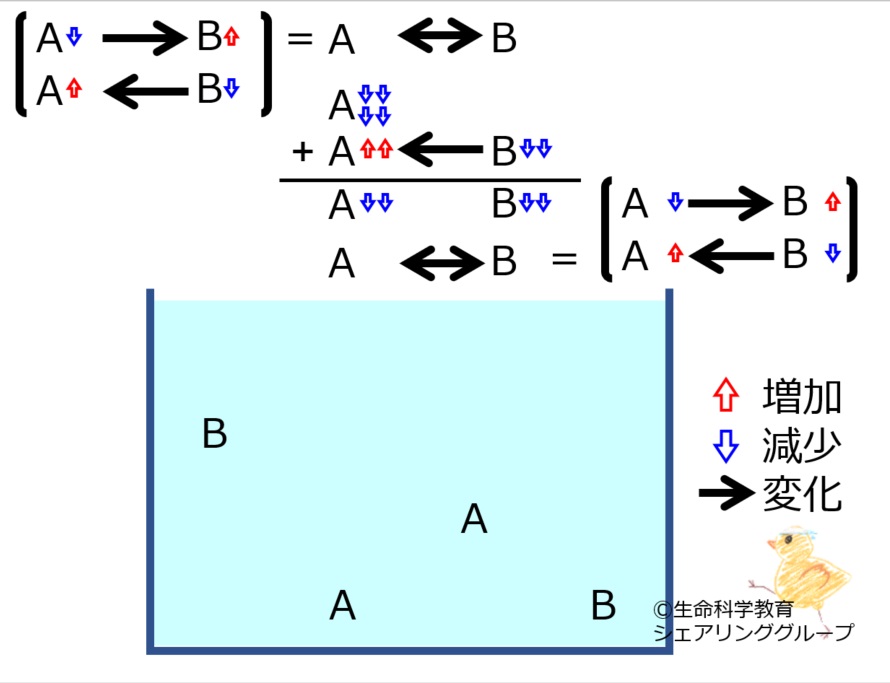
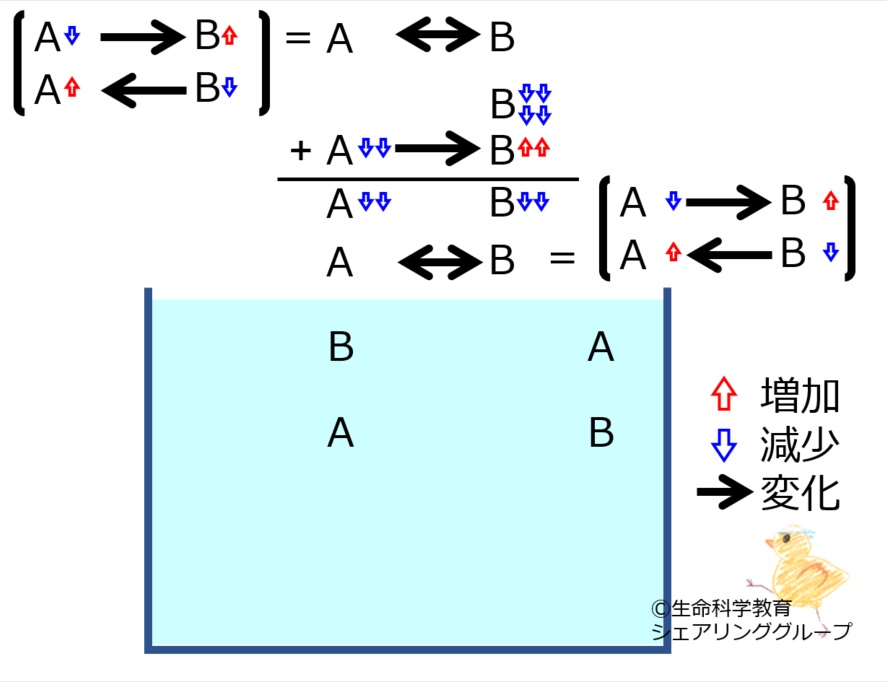
A←→Bの化学平衡を理解しておきましょう。
*いずれかの物質が増減すると、その「最初の変化を打ち消す方向」に、化学反応が進みます。
A←→Bにおいて
Aが増えた、
Bが増えた、
Aが減った、
Bが減った
それぞれの場合で進む反応の方向を理解しておきましょう。
*最初の変化は完全に消えるのではなく残ります。すなわち、「最初の変化より少ない量」化学反応が進みます。
A←→Bにおいて
Aが増えた、
Bが増えた、
Aが減った、
Bが減った
それぞれの場合で進む反応の量を理解しておきましょう。