「電解質と体液/肺、腎による酸性物質の排出と血漿緩衝系のはたらき/重炭酸緩衝系の基本的作用/重炭酸緩衝系の原理」の版間の差分
ナビゲーションに移動
検索に移動
編集の要約なし |
編集の要約なし |
||
| (同じ利用者による、間の21版が非表示) | |||
| 1行目: | 1行目: | ||
{{Point|重炭酸緩衝系は化学平衡であり、H<sup>+</sup>とCO<sub>2</sub>の | {{Point|重炭酸緩衝系は化学平衡であり、H<sup>+</sup>とCO<sub>2</sub>の いずれかの物質が増減すると、その「最初の変化を<strong><u>打ち消す方向</u></strong>」に、「最初の変化より<strong><u>少ない量</u></strong>」化学反応が進む。}} | ||
*ベースラインでは、H<sup>+</sup>もCO<sub>2</sub>も<br> | |||
H<sup>+</sup> ←→ CO<sub>2</sub> ( H<sup>+</sup> + HCO<sub>3</sub><sup>-</sup> ←→ H<sub>2</sub>O + CO<sub>2</sub> )<br> | |||
の化学平衡にあり、濃度は正常範囲です。<br> | |||
<br> | |||
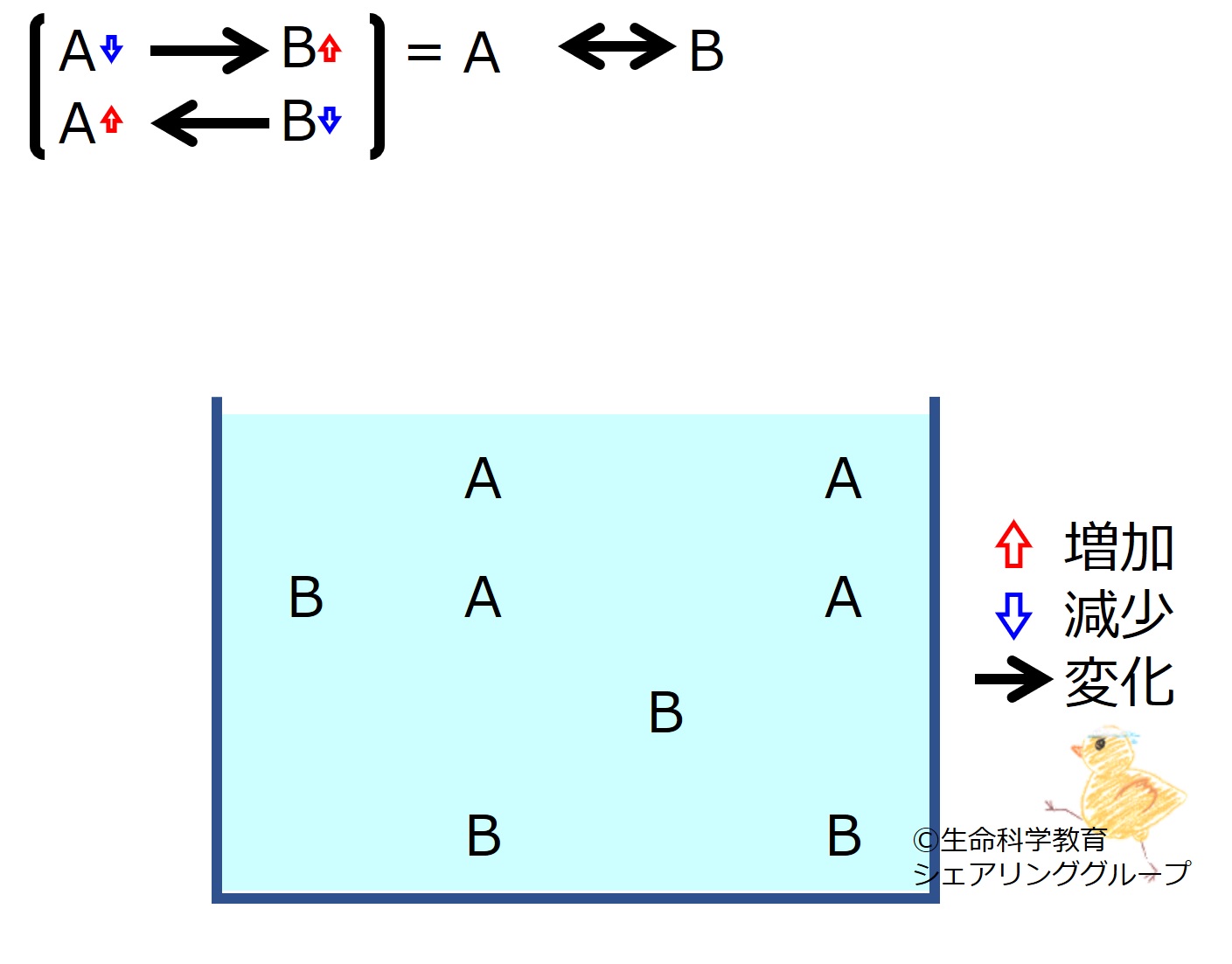
| | [http://life-science-edu.net/wiki/化学平衡とは A←→Bの化学平衡]を理解しておきましょう。<br> | ||
| style=" | <br> | ||
[[ファイル:ChemicalEquilibrium.jpg|left|350px]] | |||
*いずれかの物質が増減すると、その「最初の変化を<strong><u>打ち消す方向</u></strong>」に、化学反応が進みます。<br> | |||
| style=" | <br> | ||
*最初の変化は完全に消えるのではなく残ります。すなわち、「最初の変化より<strong><u>少ない量</u></strong>」化学反応が進みます。<br style="clear:both;" /> | |||
<br> | |||
[[ファイル:ChemicalEquilibriumChangesByIncInMolA-4.jpg|left|350px]] | |||
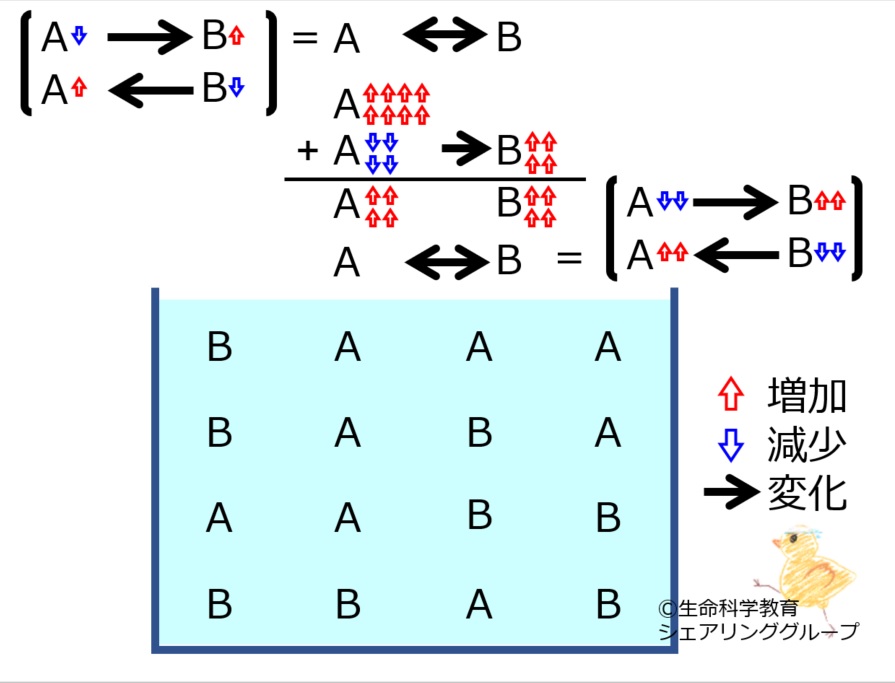
A←→Bにおいて | |||
[http://life-science-edu.net/wiki/化学平衡にある物質の増減に対する反応-2の1 Aが増えた]<br> | |||
場合に進む反応の<strong><u>量</u></strong>を理解しておきましょう。<br style="clear:both;" /> | |||
<p class="page-break" style="padding: 0px;"></p> | |||
[[ファイル:ChemicalEquilibriumChangesByIncInMolB-4.jpg|left|350px]] | |||
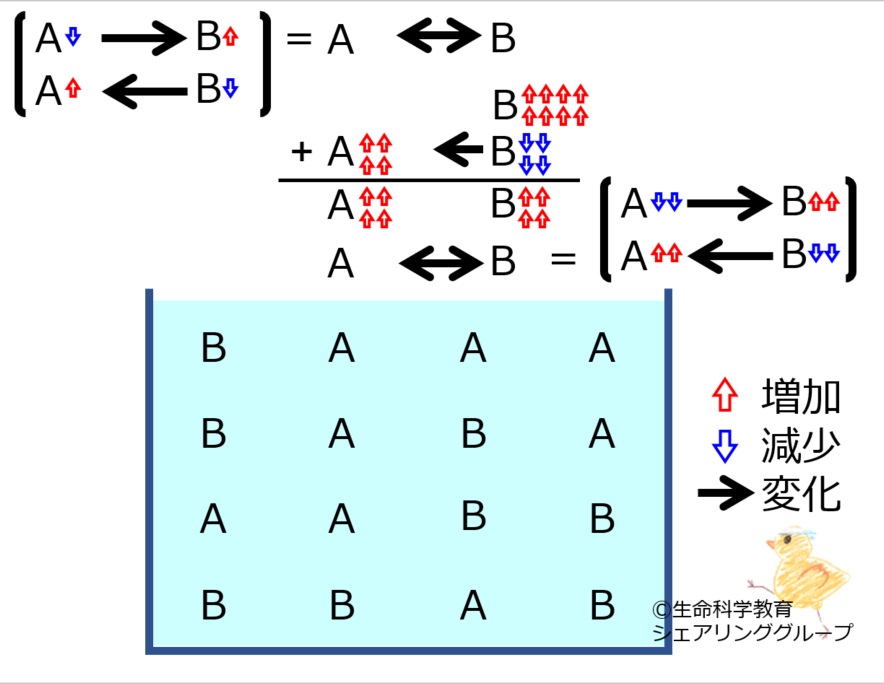
A←→Bにおいて | |||
[http://life-science-edu.net/wiki/化学平衡にある物質の増減に対する反応-2の2 Bが増えた]<br> | |||
場合に進む反応の<strong><u>量</u></strong>を理解しておきましょう。<br style="clear:both;" /> | |||
<br> | |||
[[ファイル:ChemicalEquilibriumChangesByDecInMolA-4.jpg|left|350px]] | |||
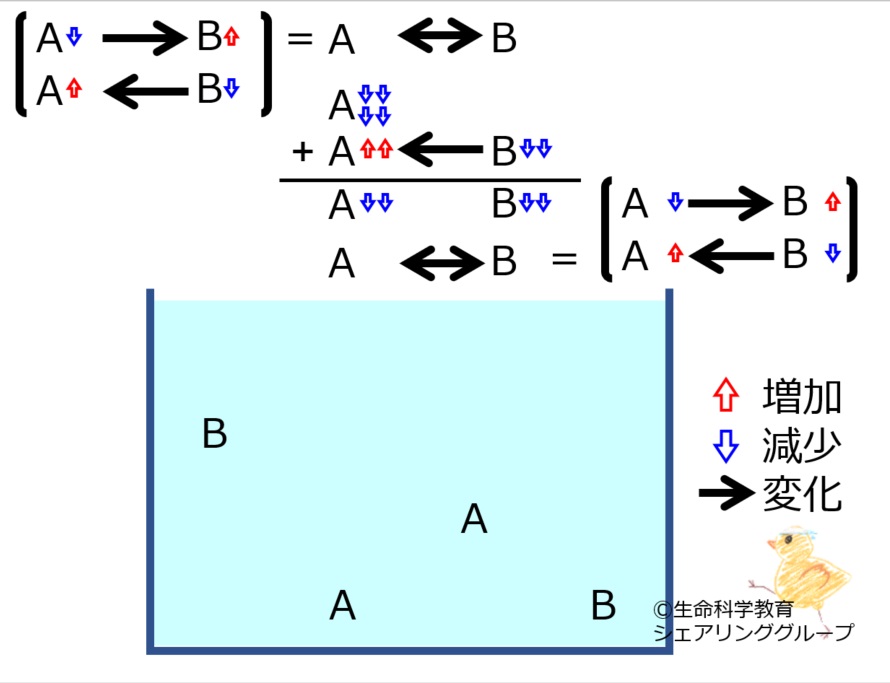
A←→Bにおいて | |||
[http://life-science-edu.net/wiki/化学平衡にある物質の増減に対する反応-2の3 Aが減った]<br> | |||
場合に進む反応の<strong><u>量</u></strong>を理解しておきましょう。<br style="clear:both;" /> | |||
<br> | |||
[[ファイル:ChemicalEquilibriumChangesByDecInMolB-4.jpg|left|350px]] | |||
A←→Bにおいて | |||
[http://life-science-edu.net/wiki/化学平衡にある物質の増減に対する反応-2の4 Bが減った]<br> | |||
場合に進む反応の<strong><u>量</u></strong>を理解しておきましょう。 | |||
<br style="clear:both;" /> | |||
<br> | |||
2023年8月3日 (木) 20:55時点における最新版
POINT!
| 重炭酸緩衝系は化学平衡であり、H+とCO2の いずれかの物質が増減すると、その「最初の変化を打ち消す方向」に、「最初の変化より少ない量」化学反応が進む。 |
*ベースラインでは、H+もCO2も
H+ ←→ CO2 ( H+ + HCO3- ←→ H2O + CO2 )
の化学平衡にあり、濃度は正常範囲です。
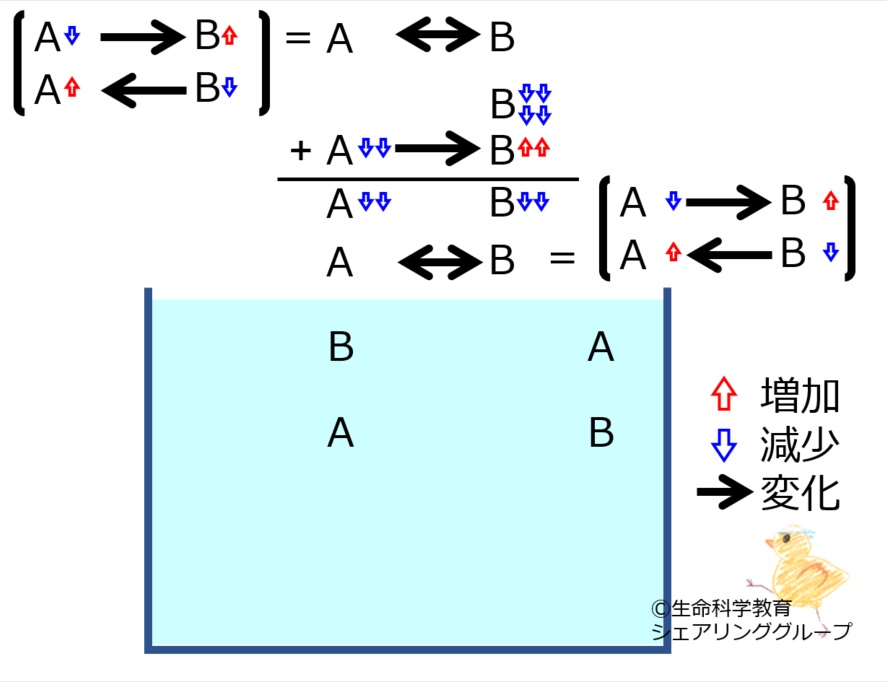
A←→Bの化学平衡を理解しておきましょう。
*いずれかの物質が増減すると、その「最初の変化を打ち消す方向」に、化学反応が進みます。
*最初の変化は完全に消えるのではなく残ります。すなわち、「最初の変化より少ない量」化学反応が進みます。
A←→Bにおいて
Aが増えた
場合に進む反応の量を理解しておきましょう。
A←→Bにおいて
Bが増えた
場合に進む反応の量を理解しておきましょう。
A←→Bにおいて
Aが減った
場合に進む反応の量を理解しておきましょう。
A←→Bにおいて
Bが減った
場合に進む反応の量を理解しておきましょう。